Cancers ultra-rares : résultats de l’étude FIRSTMAPPP financée par le PHRC-K
09/03/2022
De par leurs spécificités, certains cancers comme les phéochromocytomes et paragangliomes malins (PPM) évolutifs, caractérisés par leur extrême rareté (< 1 cas par million), représentent un challenge conséquent pour la recherche.
Un défi pourtant relevé par l’équipe du Dr Eric Baudin, chef du comité des tumeurs endocrines de Gustave Roussy, et les réseaux français COMETE-Cancers de la surrénale (labellisé par l’INCa) et européen ENSAT. Ils ont mis au jour l’efficacité d’un traitement par le Sunitinib, avec le plus haut niveau de preuves jamais atteint, pour ces cancers. Cette étude académique randomisée a été financée par le programme hospitalier de recherche clinique (PHRC-K) en 2011 et le programme européen HORIZON 2020.
Les résultats de cette étude, présentés au congrès de l’European Society for Medical Oncology (ESMO) en septembre 2021, devraient changer les pratiques thérapeutiques en 2022.
Que sont les phéochromocytomes et paragangliomes malins ?
Il s’agit de pathologies cancéreuses très rares. En effet, la plupart de ces tumeurs ont un comportement bénin. On compte environ une trentaine de cas chaque année en France, soit moins d’une personne pour 1 million atteinte de paragangliomes ou de phéochromocytomes malins (PPM) définis par la présence de métastases évolutives. Les cancers rares (définis par une incidence inférieure à 6 / 100 000) exposent les patients à la double peine du cancer et de l’absence de progrès rapides. Le développement de la recherche est en effet compliqué par la rareté et la difficulté d’obtenir des financements du secteur privé.
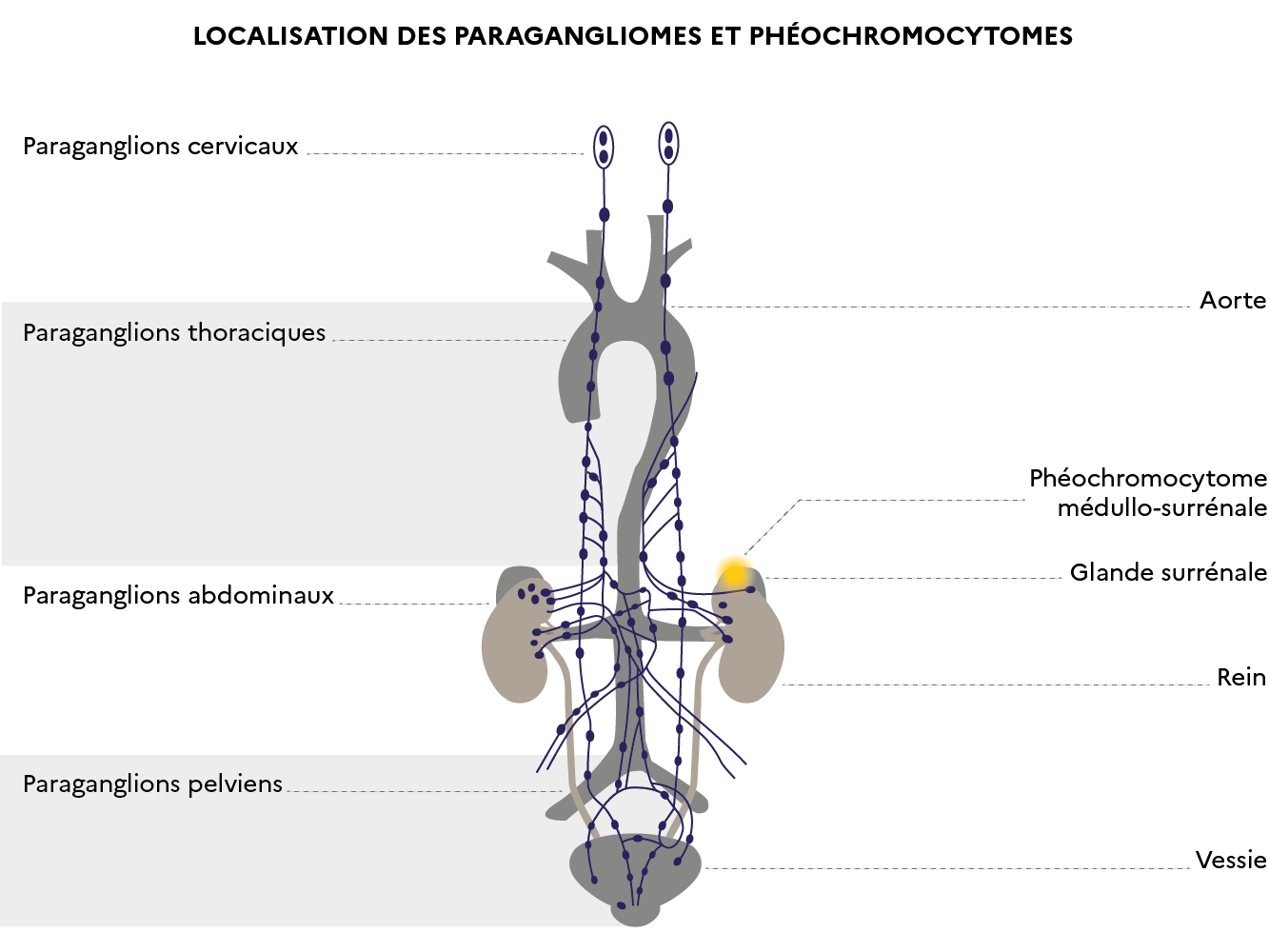
Les phéochromocytomes et paragangliomes appartiennent à la grande famille des tumeurs neuroendocrines (qui sont définies par la présence de granules de sécrétions dans le cytoplasme des cellules, sorte de réservoir d’hormones au sein des cellules, marquées spécifiquement par la chromogranine A). Les phéochromocytomes se développent aux dépens de la partie centrale de la surrénale (la médullo-surrénale). Les paragangliomes se développent au sein des paraganglions distribués le long des axes vasculaires et nerveux de la tête et du cou et le long de la colonne vertébrale, au niveau abdominal, pelvien et du thorax.
Les phéochromocytomes et paragangliomes touchent à part égale des femmes et des hommes, en moyenne âgés de 45 ans. Nombre d’entre eux sont héréditaires (pour 30 % des paragangliomes). Ils ne sont bien souvent découverts qu’au moment où se développent des métastases, observées lors d’une surveillance chez les patients classés à risque.
Outre sa rareté, ce groupe de tumeurs possède plusieurs grandes spécificités qui le distinguent des autres cancers et rendent la recherche à ce sujet extrêmement complexe. Même au stade métastatique, ces cancers peuvent être peu évolutifs. Ainsi, la survie médiane des patients atteints de métastases est de 7-8 ans et peut aller jusqu’à 10-15 ans ! Il faut donc concentrer les efforts de recherche sur les formes évolutives.
En outre, ces tumeurs sécrètent des hormones, comme par exemple les catécholamines, responsables d’une hypertension artérielle parfois sévère et causes de complications.
Quel était le but de votre étude ?
L’étude FIRSTMAPPP était la première étude randomisée internationale en double aveugle sur ces cancers [pour une étude randomisée en double aveugle, les patients sont répartis en deux groupes par tirage au sort, sans que le patient ni le personnel médical ne soient informés du traitement donné, NDLR].
Le but était d’apporter la preuve de l'intérêt d'un traitement avec la molécule Sunitinib dans ces cas de cancers très rares. Ce traitement a été sélectionné sur la base d’un consensus d’experts incluant des chercheurs spécialisés. Ce nouveau traitement testé appartient à la grande famille des anti-angiogéniques [capables de bloquer la croissance anormale des vaisseaux sanguins au sein des tumeurs, NDLR].
Dans ce contexte de survie souvent prolongée même au stade métastatique, mettre en place un protocole de recherche sur ce type de cancer rare relève du challenge. Un effort particulier a été apporté à la sélection du groupe de patients pour retrouver ceux dont le cancer était le plus agressif. On peut estimer que cela ne concerne que 30 à 50 % des personnes touchées par ces cancers.
Nous avons mis environ 8 ans pour regrouper 78 patients (au rythme de 8 patients par an recrutés dans 4 pays européens). Chacun des 15 centres sélectionnés des réseaux français et européens participants a donc inclus 0,6 patient par an. Or, rien n’est plus difficile que d’inclure moins d’un patient par an dans une étude sur une période prolongée.
Pour recruter ces patients, la mise en en place des réseaux français et européens sur les tumeurs rares a été essentielle. L’INCa a été très moteur dans la mise en place des réseaux français.
Au vu du nombre de patients éligibles, la seule étude faisable était une étude de phase II randomisée [les essais cliniques de phase II évaluent l’activité clinique ou pharmacologique antitumorale d'un traitement à la dose recommandée. Ils nécessitent en général l'inclusion de 40 à 80 malades, NDLR]. Nous avons étudié la survie prolongée sans progression de la maladie pendant un an, en évaluant les résultats obtenus avec la molécule Sunitinib ou un placebo. Nous avons fait la double hypothèse que pour 40 % des patients sous Suninitib, la maladie ne progresserait pas en un an, contre 20 % avec le placebo.
Jusque-là, nous n’avions pas de traitement standard absolu dans ce groupe de tumeurs : les traitements utilisés ne s’appuyaient que sur des recommandations d’experts basées essentiellement sur des collections de cas rétrospectives. Il s’agit notamment du traitement par radiothérapie interne vectorisée de type MIBG ou de chimiothérapie à base de dacarbazine.
Qu’est-ce que cette étude a permis de mettre au jour et quelles suites lui ont été données ?
Les deux hypothèses avancées ont été respectées, permettant de conclure positivement à l’efficacité du traitement. En effet, 35,9 % des patients ayant bénéficié du traitement par Suninitib n’ont pas eu de progression de leur cancer en un an, contre 18,9 % des patients ayant reçu le placebo. Nous avons donc validé, avec le plus haut niveau de preuves envisageable, que le traitement par Suninitib augmentait significativement les chances de blocage de l’évolution tumorale sur une période d’un an. Nous montrons également une diminution significative du volume de la tumeur dans 1/3 des cas et une tolérance acceptable du traitement, notamment lorsque l’hypertension et les douleurs sont bien contrôlées avant traitement.
Grâce à cette étude, nous avons également montré la faisabilité à l’échelle française et européenne d’une étude de phase II randomisée dans un cancer avec une incidence inférieure à 1 pour 1 million en utilisant les ressources académiques.
Cette étude est donc “pratice changing” : elle va permettre un changement de la pratique médicale. Ainsi, le Suninitib va devenir le traitement de référence pour les phéochromocytomes et paragangliomes malins (PPM) progressifs à la place de la chimiothérapie, notamment. Les recommandations devraient changer en 2022.
À noter : pour les tumeurs très rares, il est classique d’avoir un changement de pratiques cliniques à partir d’études de phase II randomisées.
Consulter l’abstract de l’étude FIRSTMAPPP (en anglais)
Le défi des cancers rares
Les cancers rares sont définis par une incidence inférieure à 6/100 000. À l’échelle européenne, près d’un cancer diagnostiqué sur quatre chaque année est une forme de cancer rare. Environ 5,1 millions d’Européens vivent avec un cancer rare.